Anvisa pode liberar uso da vacina Pfizer contra doenças respiratórias, como a bronquiolite
16:40 03/09/2023
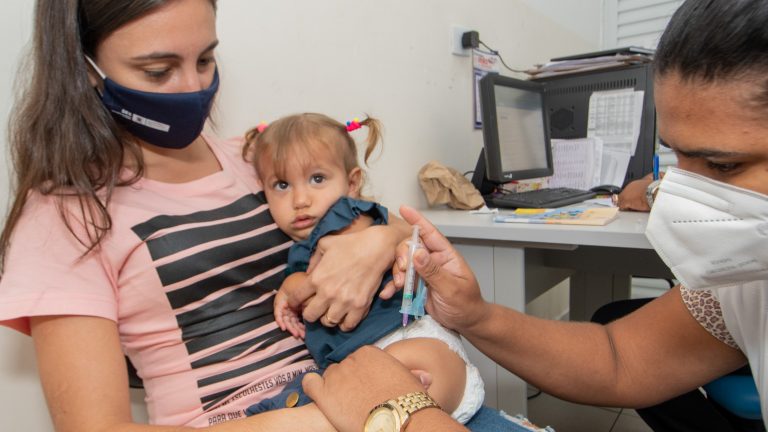
Além de imunizar gestantes, a vacina será pioneira na prevenção de crianças de 0 a seis meses e idosos a partir dos 60 anos
O imunizante Pfizer, utilizado contra a COVID-19, enviou um pedido de aprovação à Agência Nacional de Vigilância Sanitária (Anvisa) para ser a primeira vacina para proteção de recém-nascidos contra a bronquiolite, uma doença respiratória grave. A vacina chamada de ABRYSVO já está em uso nos Estados Unidos e na Europa com bons resultados preventivos.
Ao Correio do Estado, o diretor técnico da Imunitá, Dr. Alberto Jorge Félix Costa avalia como positiva a possibilidade da Anvisa aprovar e liberar o uso do imunizante Pfizer, contra a doença bronquiolite que afeta muito as crianças.
“Estávamos aguardando há anos. O vírus sincicial respiratório (VSR) é o principal causador de uma doença infecciosa viral aguda, chamada bronquiolite. O problema da bronquiolite é principalmente nas crianças pequenas, especialmente nos bebês menores de um ano. Nessa faixa etária essas crianças podem às vezes ter um desfecho muito desfavorável, como insuficiência respiratória, esforço respiratório, internação e às vezes até encaminhamento para UTI”, explica o médico sobre os riscos da doença.
Para o pediatra, diante do aumento extremo de casos de bronquiolite neste ano, quanto antes a vacina da Pfizer for liberada, será melhor para as crianças.
“A vacina contra o vírus respiratório já era uma coisa que estava se esboçando nos últimos anos, com estudos promissores. Essa vacina já existe para pessoas adultas fora do Brasil, e com sucesso tiveram bons resultados. Agora com o advento dessa vacina para crianças e para os bebês, nós estamos extremamente otimistas. Haverá uma possibilidade de uma redução desses casos de vírus respiratório e consequentemente redução das bronquiolites”, defende.
A diretora médica da Pfizer Brasil, Adriana Ribeiro, afirma que o pedido de aprovação de registro junto à ANVISA é baseado em resultados de estudos clínicos internacionais de fase 3,2 e 1 que demonstraram que a vacina é eficaz e segura na proteção de bebês e idosos.
“Demos um passo muito grande para avançar na proteção contra o VSR no Brasil. Essa inovação permitirá proteção segura e eficaz aos principais grupos de risco contra infecções causadas pelo vírus, em especial, os recém-nascidos, que por meio das mães receberão proteção importante contra esse agente nos primeiros meses de vida”, garantiu.
Ainda segundo a representante da Pfizer, o estudo fase 3 para a indicação materno-fetal contou com a participação de mais de sete mil grávidas, em 18 centros ao redor do mundo, sendo quatro deles no Brasil: dois no Rio Grande do Sul, um em Santa Catarina e um em São Paulo.
“No caso da aplicação em gestantes, a resposta imunológica gerada pela vacina foi capaz de prevenir 82% das formas graves de doenças respiratórias em crianças de até três meses, seguindo com 69% até os seis meses. Já em idosos, o imunizante mostrou alta eficácia contra quadros graves, de 85,7%.”.
Público-alvo da nova vacina
O ABRYSVO, se aprovado no Brasil, será o primeiro imunizante materno-fetal contra o vírus sincicial respiratório (VSR), o principal causador de bronquiolite nos bebês.
A vacina voltada para gestantes oferece resposta imune contra infecções do trato respiratório inferior causadas por VSR nos recém-nascidos e bebês até 6 meses de idade, principal grupo de risco para formas graves de infecções pelo vírus.
Além da indicação para gestantes, o pedido também engloba a utilização do imunizante para a proteção de idosos a partir de 60 anos, outra faixa etária de risco para quadros respiratórios graves.
Casos de doenças respiratórias
Conforme dados do Ministério da Saúde, coletados e monitorados pela iniciativa Infogripe, da Fundação Oswaldo Cruz (Fiocruz), foram notificados até o mês de julho de 2023, 71.590 casos de SRAG no Brasil.
Em Mato Grosso do Sul foram registradas sete mortes e 91 novos casos confirmados de Síndrome Respiratória Aguda Grave (SRAG), nos últimos sete dias, segundo o boletim da Secretaria Estadual de Saúde (SES), da 34ª semana epidemiológica.
Ao todo, o Estado contabiliza 496 mortes e 5.682 casos confirmados desde o começo do ano. O boletim detalha que cinco óbitos aguardam a classificação final.
A Capital reúne a maioria dos casos confirmados (41,4%) com letalidade de 9,2%. O município de Corumbá, está em segundo lugar em número com 462 (8,1%) registros e letalidade em 2,2%.
A faixa etária de um a nove anos de idade são os responsáveis por 30,5% das hospitalizações no Estado por síndrome respiratória aguda grave. Já 27,4% das mortes são de idosos com 80 anos ou mais.
O vírus sincicial respiratório representa 41,4% dos agentes etiológicos detectados. O SARS-CoV-2, responsável pela Covid-19, vem em seguida, com 17,3% dos casos. Contudo, o Mapa de Incidência dos Casos Novos de SRAG mostra uma tendência de redução de casos em várias cidades de Mato Grosso do Sul.
Prevenção
O VSR é um RNA vírus da mesma família de outros mais conhecidos, como o sarampo, e é uma das principais causas de bronquiolite, infecção respiratória, e pneumonia em crianças e idosos. É a maior causa de internação de crianças até 4 anos no Brasil.
A bronquiolite é uma inflamação bastante preocupante da parte final dos brônquios, que atinge crianças pequenas e bebês. Atualmente, não há nenhum medicamento disponível no país com indicação preventiva para essa doença.
Com maior incidência nos meses de outono e inverno, mas com circulação durante todo ano, é transmitido pelo ar por meio de partículas de saliva. A prevenção é similar às outras infecções de causa viral, devendo-se evitar ambientes fechados e com aglomeração de pessoas. Lavar as mãos com sabão ou usar álcool em gel e o uso de máscaras faciais.
Pedido de registro
O pedido de registro de vacina da Pfizer para bronquiolite foi feito no dia 28 de agosto de 2023. A análise de pedidos de registro de vacinas segue uma regulamentação própria e busca verificar se a relação benefício/risco do produto é satisfatória no contexto epidemiológico atual.
A análise de vacinas pela Anvisa é feita de forma conjunta, por três áreas distintas: A área de Produtos Biológicos, que avalia os aspectos de qualidade, segurança e eficácia; A área de Farmacovigilância, responsável pelo monitoramento e planos de acompanhamento da vacina após sua entrada em uso no país; e a área de Inspeção e Fiscalização, responsável pela avaliação das Boas Práticas de Fabricação.
Após a análise inicial, caso a Agência considere necessário, podem ser feitas exigências para esclarecimentos ou complementação de informações. Se aprovado, o registro é o sinal verde para que a vacina seja comercializada, distribuída e utilizada pela população, nos termos da indicação estabelecida em sua bula.
Atualmente, há outro pedido de registro de vacina contra o VSR, a vacina Arexvy, da empresa GlaxoSmith Kline, também em análise pela Anvisa.
Via Correio do Estado MS




Comente esta notícia
compartilhar